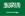1. Dissociazione diretta e adsorbimento delle molecole d'acqua
Sui siti metallici insaturi di ossidi metallici o ossidi semiconduttori (come Ti4+, Fe3+), le molecole d'acqua vengono prima adsorbite in forma molecolare, seguite dalla scissione del legame OH, risultando in ponti o gruppi idrossilici terminali (M-OH) e atomi di idrogeno superficiali. La forza trainante termodinamica di questo processo deriva dalla forte acidità Lewis degli ioni metallici, che rende le molecole d’acqua facili da dissociare. Sia gli esperimenti che i calcoli DFT indicano che le superfici coperte con un basso livello di ossigeno tendono a dissociarsi e ad adsorbire, mentre le superfici coperte con un alto contenuto di ossigeno tendono ad adsorbire le molecole.
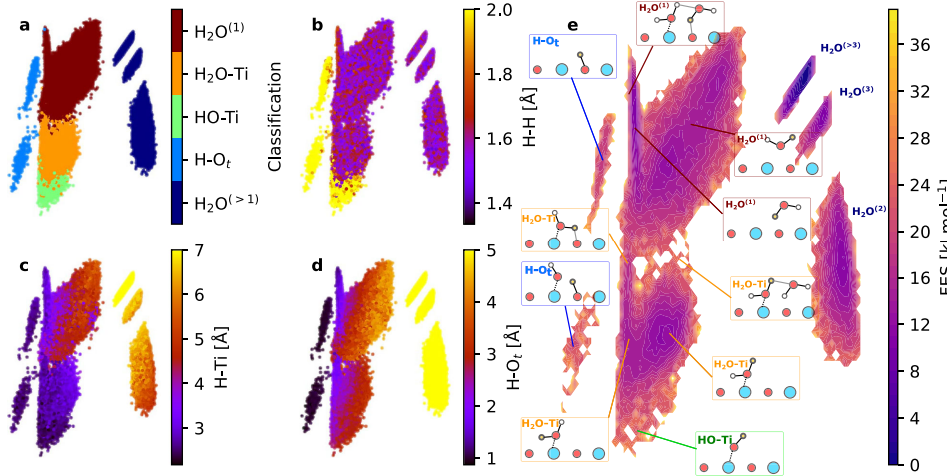
2. Generazione di idrossili mediata da posti vacanti di ossigeno (VO).
I posti vacanti di ossigeno superficiale forniscono elettroni, rendendo le molecole d’acqua adsorbite più inclini alla dissociazione. Dopo che le molecole d'acqua si sono assorbite nel posto vacante, vengono generati due gruppi idrossilici, uno dei quali riempie il posto vacante e l'altro si aggancia al metallo adiacente. Questo meccanismo spiega il fenomeno dell'aumento significativo della densità di ossidrile in condizioni riducenti o di alta temperatura ed è strettamente correlato ai cambiamenti nel numero di coordinazione degli ioni metallici.
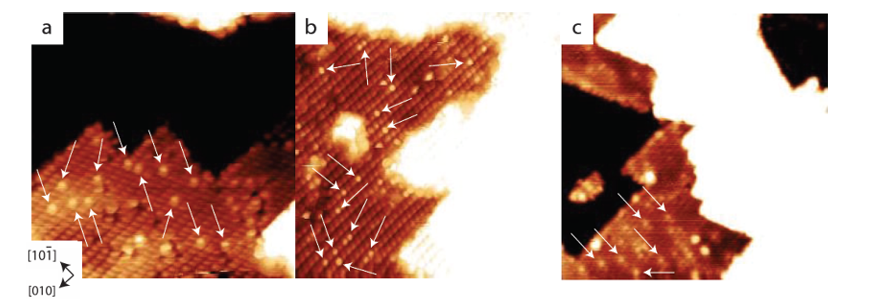
3.Trabocco dell'idrogeno o dell'atomo di idrogeno
All'interfaccia metallo/ossido, H2 si dissocia sul metallo per formare H ⁺/H ⁻, che poi migra sulla superficie dell'ossido metallico attraverso il trabocco di idrogeno e forma gruppi ossidrile con l'ossigeno superficiale. Questo processo è stato osservato direttamente in sistemi catalitici come l’ossidazione della CO a bassa temperatura e il traboccamento di idrogeno ha aumentato significativamente la velocità di generazione del gruppo ossidrile superficiale.
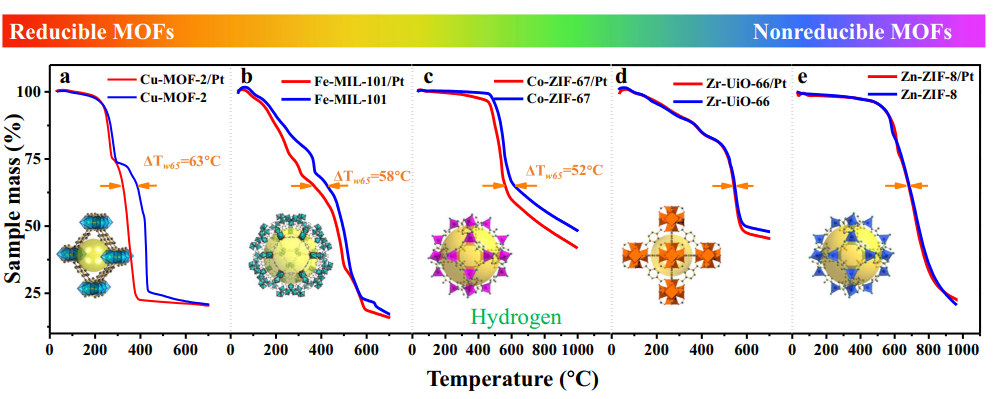
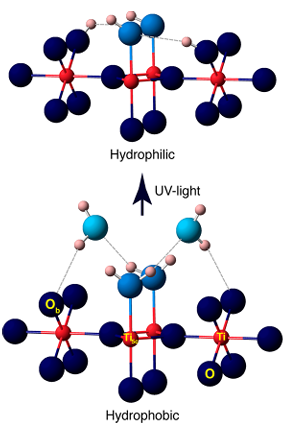
4.Formazione di idrossili indotta da fotocatalisi/UV
La luce UV eccita semiconduttori come TiO2 per generare coppie di lacune elettroniche, che catturano gli atomi di ossigeno superficiali per formare O ⁻, e quindi reagiscono con molecole d'acqua adsorbite o gruppi idrossilici per generare OH ⁻ superficiale, accompagnato dalla produzione di radicali idrossilici (· OH). Gli esperimenti hanno dimostrato che l'irradiazione UV genera ulteriori posti vacanti di ossigeno sulla superficie del TiO2, che reagiscono ulteriormente con l'acqua per generare più gruppi idrossilici, portando alla superidrofilicità fotoindotta.
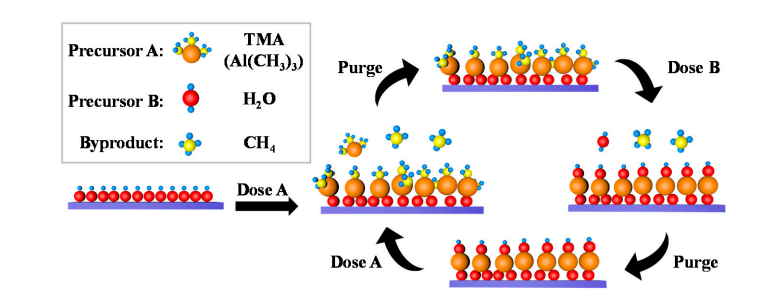
5.Formazione di gruppi idrossilici sulla superficie dell'ossido di alluminio
Una piccola quantità di gruppi idrossilici esiste naturalmente sulla superficie dell'ossido di alluminio e le molecole d'acqua si dissociano e si adsorbono su questi gruppi idrossilici, producendo nuovo Al-OH. Durante la deposizione dello strato atomico (ALD), il TMA (trimetilalluminio) subisce uno scambio di coordinazione con i gruppi idrossilici superficiali per formare legami Al-O-Al e rilasciare metano; Successivamente, l'impulso dell'acqua reagisce nuovamente con i legami Al-O per rigenerare i gruppi idrossilici superficiali, ottenendo la rigenerazione ciclica dei gruppi idrossilici.
6.Ricostruzione della superficie - La migrazione dei metalli porta all'aggregazione degli ossidrili
Sulla superficie cristallina dell'allumina o dell'ossido di titanio, gli ioni metallici locali (come Al3+) migrano verso i posti vacanti superficiali ad alta temperatura o ad alto potenziale idrochimico, formando cluster idrossilici di tipo Al (OH) 3 o Ti (OH) 3. Questa ricostruzione è accompagnata da una distorsione del reticolo, che rende più favorevole l'adsorbimento dei gruppi ossidrilici sulle molecole d'acqua adiacenti, formando uno strato di base idrossilico ad alta densità.
7. Il meccanismo di idrolisi dei gruppi idrossilici sulla superficie del silicio
Nel legame a ponte Si-O-Si, le molecole d'acqua si combinano con il legame ossigeno del silicio attraverso il trasferimento sinergico di elettroni protonici, formando gruppi Si-OH. Questo processo è particolarmente importante nella tensocorrosione all'estremità della fessura e nell'idrolisi superficiale del vetro, e l'aumento della vibrazione di trazione Si-OH è stato osservato direttamente mediante spettroscopia infrarossa sperimentale.
SAT NANO è il miglior fornitore di nanopolveri e microparticelle in Cina, possiamo offrire polvere di nanotubi di carbonio, come ad esempio
MWCNT-COOH,
MWCNT-OH, se hai qualche domanda, non esitare a contattarci all'indirizzo sales03@satnano.com